A03
IAPアンタゴニスト-IAPペアのBump and Hole改変による新しいタンパク質分解系

内藤 幹彦
東京大学大学院薬学系研究科(薬学部) 特任教授
https://tpd.f.u-tokyo.ac.jp/
researchmap: https://researchmap.jp/read0160771
東京大学大学院薬学系研究科(薬学部) 特任教授
https://tpd.f.u-tokyo.ac.jp/
researchmap: https://researchmap.jp/read0160771
概要
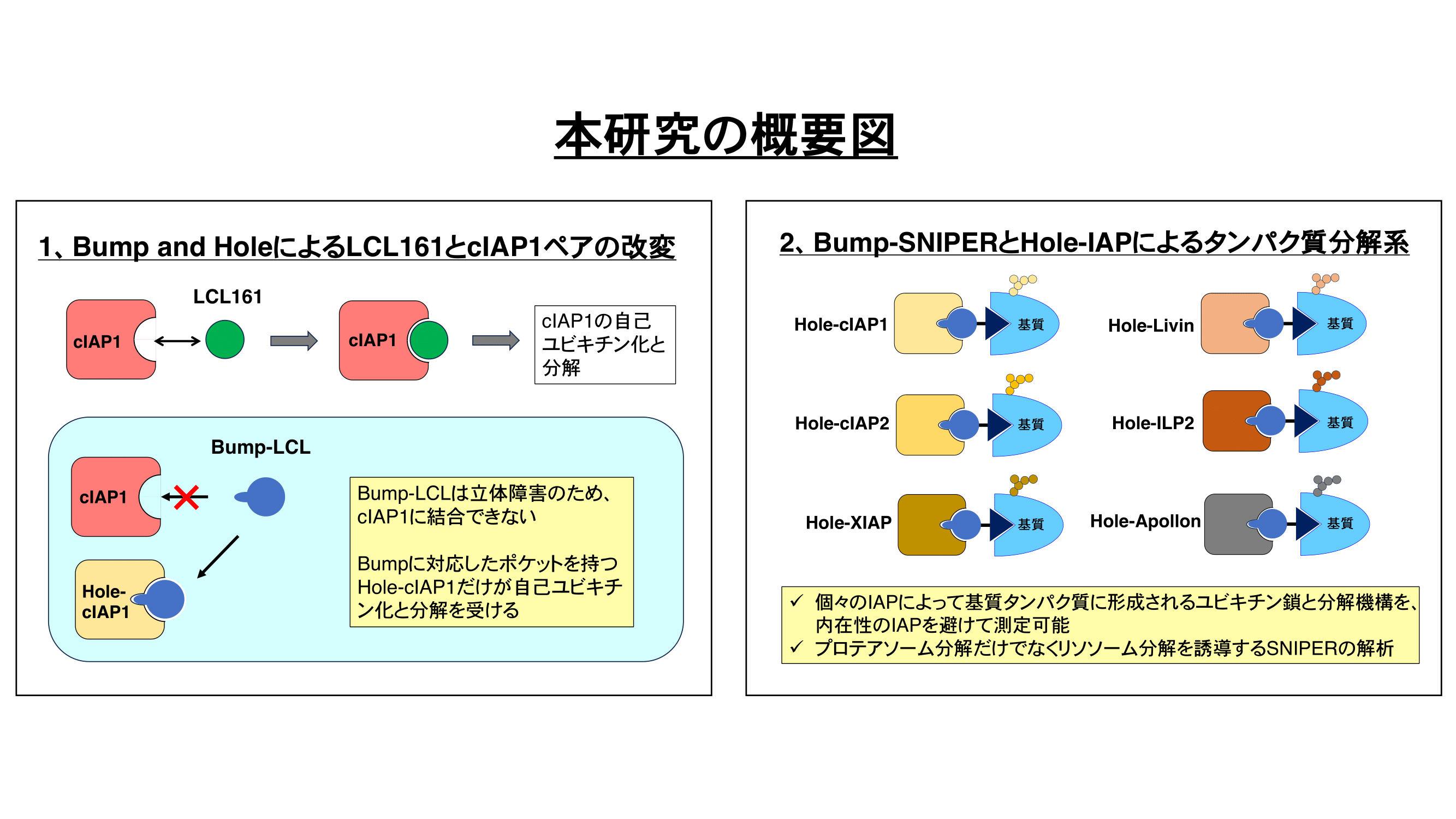
PROTACは標的タンパク質とE3ユビキチンリガーゼを近接させて、標的タンパク質のユビキチン化と分解を誘導する。我々が開発したIAP-based PROTAC(SNIPER)はK63鎖のユビキチン鎖を形成するIAPを利用してさまざまな標的タンパク質の分解を誘導するため、K63鎖の機能を解析する有用なツールになると考えられる。SNIPERは内在性のIAP(XIAP、cIAP1等)を利用して標的タンパク質をユビキチン化するが、多くの細胞は複数のIAPファミリータンパク質を発現している。そのため個々のIAPがどのようなユビキチン鎖を形成しどのような細胞応答を誘導するかについて、これまでのSNIPER技術では詳細に解析することはできなかった。本研究ではBump and Hole法に基づいてIAPアンタゴニスト-IAPペアを改変し、IAPによって形成されるユビキチン鎖と細胞応答の違いを、内在性IAPの影響を受けずに個別に解析する技術を確立する。この技術を利用してBump-SNIPERを開発し、E3ユビキチンリガーゼ活性を持つ6種類(cIAP1、cIAP2、XIAP、Livin、ILP2、Apollon)のIAPファミリータンパク質の機能的な違い(特に形成するユビキチン鎖、プロテアソーム分解誘導能、リソソーム分解誘導能など)を解析すると共に、K63鎖が示す機能的な役割を明らかにする。
- Akizuki Y., Morita M., Mori Y., Kaiho-Soma A., Dixit S., Endo A., Shimogawa M., Hayashi G., Naito M., Okamoto A., Tanaka K., Saeki Y., & Ohtake F. (2023) cIAP1-based degraders induce degradation via branched ubiquitin architectures. Nat Chem Biol. 19, 311–322
- Naito M. (2022) Targeted protein degradation and drug discovery. The Journal of Biochemistry. 172, 61–69
- Kaiho-Soma A., Akizuki Y., Igarashi K., Endo A., Shoda T., Kawase Y., Demizu Y., Naito M., Saeki Y., Tanaka K., & Ohtake F. (2021) TRIP12 promotes small-molecule-induced degradation through K29/K48-branched ubiquitin chains. Mol Cell. 81, 1411-1424.e7
- Naito M., Ohoka N., & Shibata N. (2019) SNIPERs—Hijacking IAP activity to induce protein degradation. Drug Discov Today Technol. 31, 35–42
- Ohoka N., Okuhira K., Ito M., Nagai K., Shibata N., Hattori T., Ujikawa O., Shimokawa K., Sano O., Koyama R., Fujita H., Teratani M., Matsumoto H., Imaeda Y., Nara H., Cho N., & Naito M. (2017) In Vivo Knockdown of Pathogenic Proteins via Specific and Nongenetic Inhibitor of Apoptosis Protein (IAP)-dependent Protein Erasers (SNIPERs). Journal of Biological Chemistry. 292, 4556–4570
