A02
ヘテロユビキチンリガーゼがもたらすユビキチン化基質認識機構の新展開

弓本 佳苗
九州大学生体防御医学研究所 准教授
http://www.scc.kyushu-u.ac.jp/horilab/
researchmap: https://researchmap.jp/ymkana
九州大学生体防御医学研究所 准教授
http://www.scc.kyushu-u.ac.jp/horilab/
researchmap: https://researchmap.jp/ymkana
概要
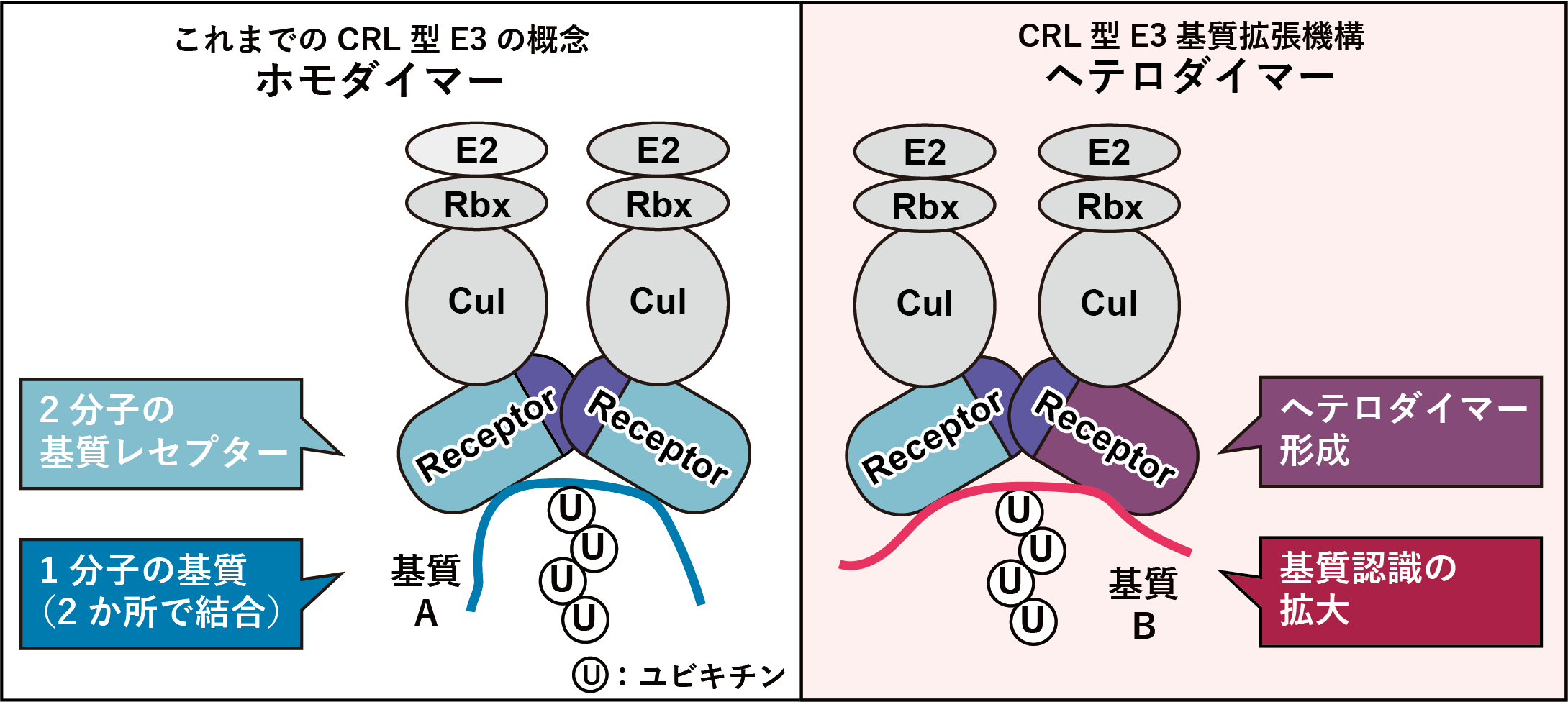
ユビキチン介在性のタンパク質分解機構は、さまざまなシグナル伝達因子や細胞周期制御因子などの量的制御を司っており、広範な生命現象への関与が示されている。ヒトゲノム情報の解読により、ドメイン構造よりヒトユビキチンリガーゼ(E3)は600種類程度存在すると言われている。一方、ユビキチン化されるタンパク質はヒト細胞で約9200種類にも及ぶことが報告された。このことから、単純計算で1つのE3は15種類以上のタンパク質をユビキチン化する必要があるが、1つのE3が15以上の分子をユビキチン化することが判明している例はごく少数であり、E3は基質の認識方法を何らかの方法で拡張していると考えられる。生命がしばしば採る戦略として、組み合わせを利用することによって多様性を増すことがある(例:免疫グロブリン遺伝子の再構成)ことを鑑み、E3も同様な方法で多様性を拡張しているのではないかと考えられた。われわれは予備的研究において、CRL型E3の基質レセプタータンパク質がヘテロダイマーを形成し、その組み合わせを変化させることで基質認識の多様性を拡張している可能性を見出した。本研究ではこの新規の基質選択性拡張機構がタンパク質寿命決定に及ぼす影響を明らかにする。本研究により、ユビキチン化によるタンパク質分解機構の複雑性と多様性に対する新たな理解が生まれ、将来的には疾患治療や細胞制御への応用が期待される。
- Yumimoto K., Sugiyama S., Motomura S., Takahashi D., & Nakayama K. I. (2023) Molecular evolution of Keap1 was essential for adaptation of vertebrates to terrestrial life. Sci Adv. 10.1126/sciadv.adg2379
- Yumimoto K., & Nakayama K. I. (2020) Recent insight into the role of FBXW7 as a tumor suppressor. Semin Cancer Biol. 67, 1–15
- Yumimoto K., Akiyoshi S., Ueo H., Sagara Y., Onoyama I., Ueo H., Ohno S., Mori M., Mimori K., & Nakayama K. I. (2015) F-box protein FBXW7 inhibits cancer metastasis in a non-cell-autonomous manner. Journal of Clinical Investigation. 10.1172/JCI78782
- Hirano A., Yumimoto K., Tsunematsu R., Matsumoto M., Oyama M., Kozuka-Hata H., Nakagawa T., Lanjakornsiripan D., Nakayama K. I., & Fukada Y. (2013) FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of cryptochromes. Cell. 10.1016/j.cell.2013.01.054
