A02
p97とその補因子によるSUMO化・分岐型ユビキチン鎖に対する応答の解析

佐藤 裕介
鳥取大学工学研究科 准教授
http://nagano-lab.chembio.tottori-u.ac.jp/index.html
researchmap: https://researchmap.jp/yusuke-sato
鳥取大学工学研究科 准教授
http://nagano-lab.chembio.tottori-u.ac.jp/index.html
researchmap: https://researchmap.jp/yusuke-sato
概要
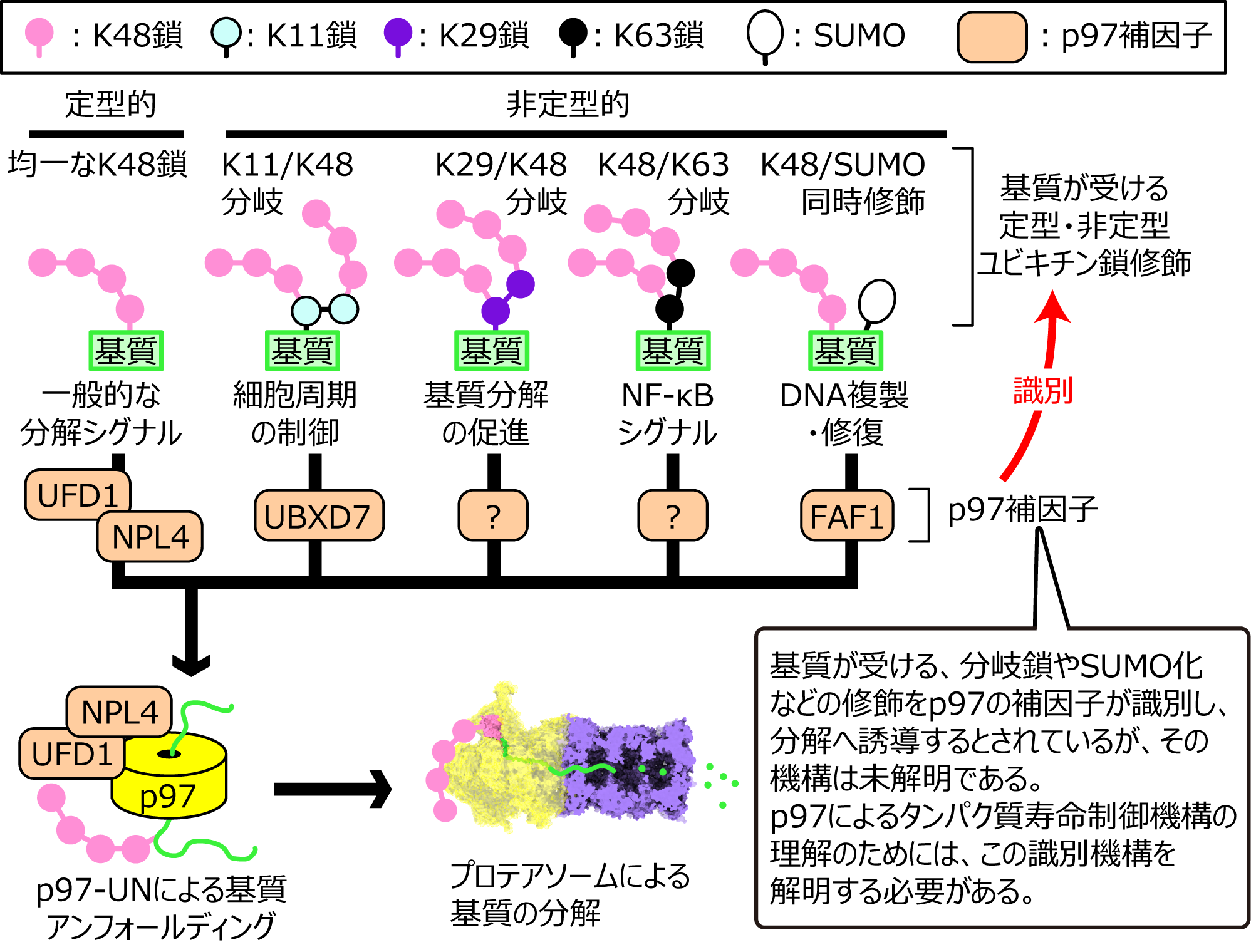
p97は主にユビキチン鎖修飾を受けた基質をアンフォールディングしてプロテアソーム分解へと導く、タンパク質寿命を決定する上で中心的な役割を果たす分子の一つである。また、p97は約30種類の補因子により基質特異性が制御され、アンフォールディングする対象を変更することで細胞周期制御やDNA修復など、多岐にわたる細胞機能を制御する。たとえば、補因子の一つであるUFD1-NPL4ヘテロダイマー(UN)は、K48で連結したユビキチン鎖(K48鎖)と特異的に結合し、ユビキチン鎖修飾された基質のp97によるアンフォールディングを起こすのに必須である。一方、細胞内でUBXD7はK11/K48で分岐したユビキチン鎖で修飾された基質の、FAF1はSUMOとK48鎖の同時修飾を受けた基質のp97による分解を促進する事が報告されている。しかし、これらの補因子がどのように、分岐鎖やSUMOによって修飾された基質に対するp97の活性を亢進するのか、その具体的なメカニズムはほとんど明らかにされていない。本研究では試験管内で分岐鎖や、SUMO修飾された基質を合成する。そして、得られた基質に対して、p97とその補因子の活性がどのように変化するのかを解析し、細胞内における非定型型ユビキチン鎖によるタンパク質寿命決定機構を明らかにする。
- Sato Y. (2022) Structural basis for the linkage specificity of ubiquitin-binding domain and deubiquitinase. The Journal of Biochemistry. 172, 1–7
- Sato Y., Tsuchiya H., Yamagata A., Okatsu K., Tanaka K., Saeki Y., & Fukai S. (2019) Structural insights into ubiquitin recognition and Ufd1 interaction of Npl4. Nat Commun. 10, 5708
- Sato Y., Okatsu K., Saeki Y., Yamano K., Matsuda N., Kaiho A., Yamagata A., Goto-Ito S., Ishikawa M., Hashimoto Y., Tanaka K., & Fukai S. (2017) Structural basis for specific cleavage of Lys6-linked polyubiquitin chains by USP30. Nat Struct Mol Biol. 24, 911–919
- Sato Y., Goto E., Shibata Y., Kubota Y., Yamagata A., Goto-Ito S., Kubota K., Inoue J., Takekawa M., Tokunaga F., & Fukai S. (2015) Structures of CYLD USP with Met1- or Lys63-linked diubiquitin reveal mechanisms for dual specificity. Nat Struct Mol Biol. 22, 222–229
- Sato Y., Yoshikawa A., Yamagata A., Mimura H., Yamashita M., Ookata K., Nureki O., Iwai K., Komada M., & Fukai S. (2008) Structural basis for specific cleavage of Lys 63-linked polyubiquitin chains. Nature. 455, 358–362
