A02
リソソーム損傷応答とタンパク質寿命変容

概要
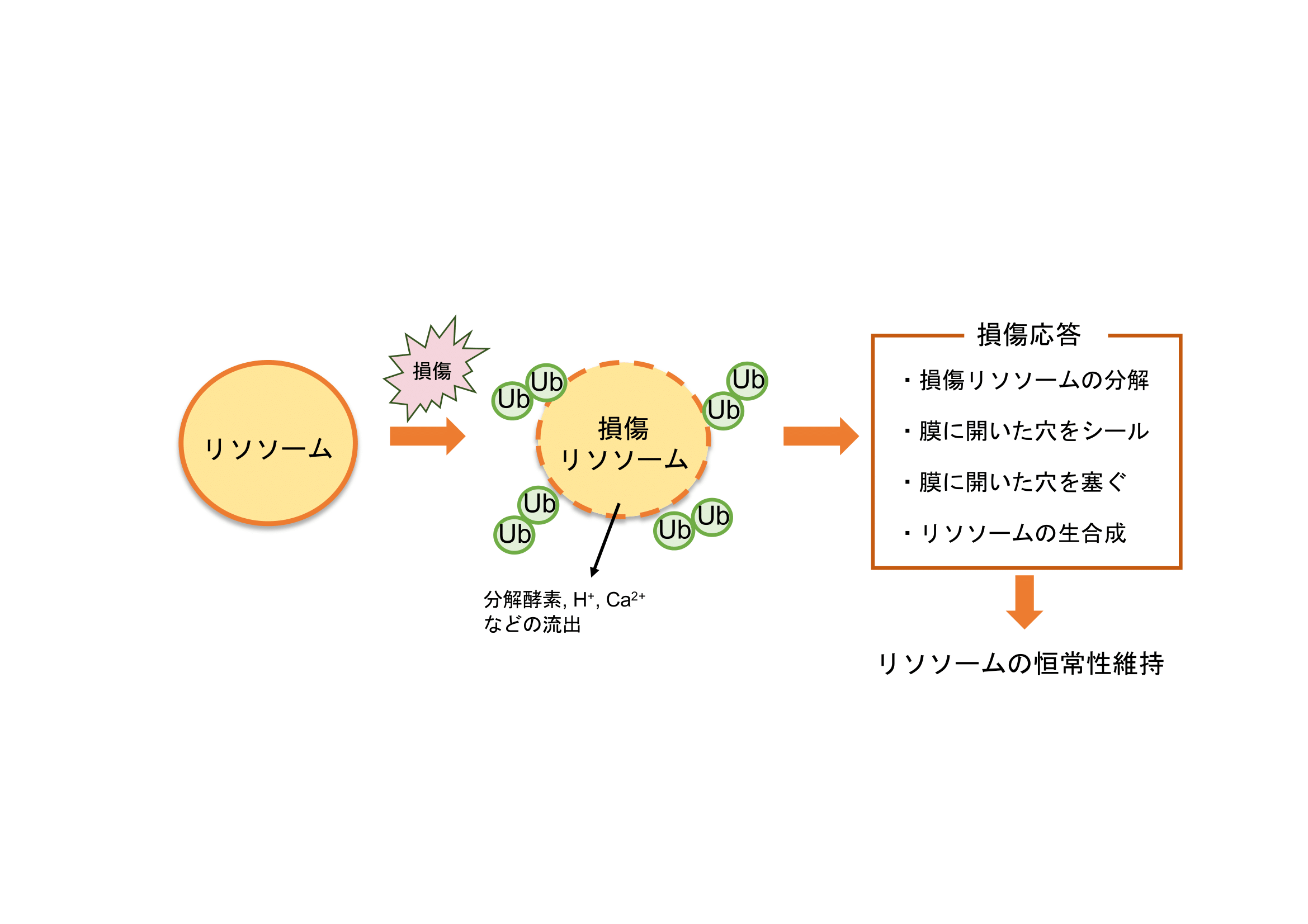
リソソームはバルクなタンパク質分解を得意とするオルガネラであり、細胞内プロテオームの変化・変容に大きく関与すると考えられる。よって、その恒常性を維持することは重要である。リソソーム膜が損傷を受けると、様々なリソソーム損傷応答が起こることが明らかになりつつあるが、各経路の関連や分子機構の詳細などよくわかっていないことが多い。本研究では、損傷リソソーム特異的オートファジー(リソファジー)を中心に、リソソーム損傷応答の分子機構解明に取り組む。また、リソソームが損傷すると高度にユビキチン化されるが、その実態はよくわかっていない。これまでに複数のE2(ユビキチン結合酵素)、E3(ユビキチンリガーゼ)が関わることが報告されており、損傷リソソーム上で新たなプロテオームが形成されることが示唆される。本研究では、損傷リソソーム上のプロテオームリモデリングの実態と意義についても解析する。これらの解析により、タンパク質寿命変容を支える「リソファジーの恒常性維持」の理解を目指す。
- Kitta S., Kaminishi T., Higashi M., Shima T., Nishino K., Nakamura N., Kosako H., Yoshimori T., & Kuma A. (2024) YIPF3 and YIPF4 regulate autophagic turnover of the Golgi apparatus. EMBO J. 10.1038/s44318-024-00131-3
- Kakuda K., Ikenaka K., Kuma A., Doi J., Aguirre C., Wang N., Ajiki T., Choong C.-J., Kimura Y., Badawy S. M. M., Shima T., Nakamura S., Baba K., Nagano S., Nagai Y., Yoshimori T., & Mochizuki H. (2024) Lysophagy protects against propagation of α-synuclein aggregation through ruptured lysosomal vesicles. Proc Natl Acad Sci U S A. 121, e2312306120
- Shima T., Ogura M., Matsuda R., Nakamura S., Jin N., Yoshimori T., & Kuma A. (2023) The TMEM192-mKeima probe specifically assays lysophagy and reveals its initial steps. J Cell Biol. 10.1083/jcb.202204048
- Saito T., Kuma A., Sugiura Y., Ichimura Y., Obata M., Kitamura H., Okuda S., Lee H.-C., Ikeda K., Kanegae Y., Saito I., Auwerx J., Motohashi H., Suematsu M., Soga T., Yokomizo T., Waguri S., Mizushima N., & Komatsu M. (2019) Autophagy regulates lipid metabolism through selective turnover of NCoR1. Nat Commun. 10, 1567
- Yoshii S. R., Kuma A., Akashi T., Hara T., Yamamoto A., Kurikawa Y., Itakura E., Tsukamoto S., Shitara H., Eishi Y., & Mizushima N. (2016) Systemic Analysis of Atg5-Null Mice Rescued from Neonatal Lethality by Transgenic ATG5 Expression in Neurons. Dev Cell. 39, 116–130
