A01
胚発生における小胞体関連分解基質の網羅的同定と寿命解析

吉田 雪子
公益財団法人東京都医学総合研究所基礎医科学研究分野 研究室長
https://www.igakuken.or.jp/pro-meta/
researchmap: https://researchmap.jp/read0000903
公益財団法人東京都医学総合研究所基礎医科学研究分野 研究室長
https://www.igakuken.or.jp/pro-meta/
researchmap: https://researchmap.jp/read0000903
概要
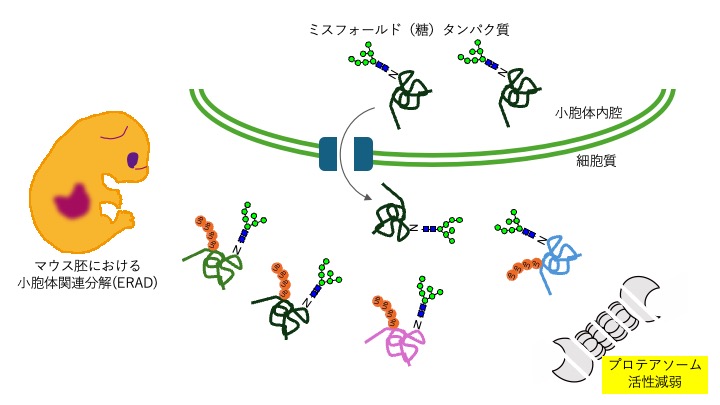
小胞体関連分解(ERAD)はユビキチン・プロテアソーム系による重要な細胞内品質管理機構である。主要なERAD関連遺伝子のノックアウトマウスは胚性致死となることから、胚発生においても重要な機構と考えられる。ERADの実行を担うERAD関連分子群は、これまでの活発な研究からかなり詳しく解明されてきているが、この機構の解析の多くは、病原性の変異をもつモデルタンパク質を用いた系でなされ、変異を持たない糖タンパク質が実際にどれ程この系で分解されているのかは明確ではない。ERADは、立体構造形成に失敗したタンパク質の分解だけではなく、構成的に分解される基質の存在も報告され、積極的なプロテオームの制御を担う系としても理解されてきている。本研究は、糖鎖除去酵素を欠失させることでプロテアソーム活性が減弱したマウス胚よりユビキチン化糖タンパク質を網羅的に同定することにより、発生において重要なERADをプロテオームワイドに理解するものである。同定した基質とターゲティング分子の対応と解析を通じ、ERAD基質が選択されるために必要な情報の実態を明らかにすることを目的とする。
- Yoshida Y., Asahina M., Murakami A., Kawawaki J., Yoshida M., Fujinawa R., Iwai K., Tozawa R., Matsuda N., Tanaka K., & Suzuki T. (2021) Loss of peptide: N -glycanase causes proteasome dysfunction mediated by a sugar-recognizing ubiquitin ligase. Proceedings of the National Academy of Sciences. 10.1073/pnas.2102902118
- Yoshida Y., & Tanaka K. (2018) Cytosolic N-Glycans: Triggers for Ubiquitination Directing Proteasomal and Autophagic Degradation: Molecular Systems for Monitoring Cytosolic N-Glycans as Signals for Unwanted Proteins and Organelles. BioEssays. 10.1002/bies.201700215
- Yoshida Y., Yasuda S., Fujita T., Hamasaki M., Murakami A., Kawawaki J., Iwai K., Saeki Y., Yoshimori T., Matsuda N., & Tanaka K. (2017) Ubiquitination of exposed glycoproteins by SCFFBXO27 directs damaged lysosomes for autophagy. Proc Natl Acad Sci U S A. 114, 8574–8579
- Yoshida Y., Saeki Y., Murakami A., Kawawaki J., Tsuchiya H., Yoshihara H., Shindo M., & Tanaka K. (2015) A comprehensive method for detecting ubiquitinated substrates using TR-TUBE. Proc Natl Acad Sci U S A. 112, 4630–4635
- Kumanomidou T., Nishio K., Takagi K., Nakagawa T., Suzuki A., Yamane T., Tokunaga F., Iwai K., Murakami A., Yoshida Y., Tanaka K., & Mizushima T. (2015) The structural differences between α glycoprotein specific F-box protein Fbs1 and its homologous protein FBG3. PLoS One. 10.1371/journal.pone.0140366
